¿POR QUE ES IMPORTANTE ALMACENAR CORRECTAMENTE LOS REACTIVOS EN UN LABORATORIO?
Es muy importante hacer este trabajo, ya que, separamos los reactivos que no se pueden ubicar en la misma zona, ponemos en las condiciones adecuadas a cada uno de ello (temperatura y ventilación), ponemos cada sustancia en el recipiente que corresponde y además creamos un ambiente laboral mas seguro y ordenado para el trabajador.
¿COMO ALMACENAR REACTIVOS DENTRO DE UN LABORATORIO QUÍMICO?
El primer paso a seguir, es identificar los riesgos de cada una de las sustancias, para lo
cual se sugiere seguir las directrices del sistema de Naciones Unidas.
Parte de la identificación de los riesgos constituye la revisión de ciertos aspectos, que
se describen a continuación:
1. ETIQUETASLas etiquetas de los productos químicos deben estar siempre en buen estado, ser
legibles, ellas contienen información necesaria sobre el manejo seguro y
almacenamiento, símbolos de peligrosidad, indicaciones sobre riesgos y consejos de
seguridad.
Siempre lea la etiqueta antes de mover, manejar, o abrir un envase de cualquier producto químico.
2. ENVASES La observación rutinaria del estado de los envases junto con sus etiquetas, ayuda a
prevenir accidentes. Los envases deben mantenerse en perfecto estado. Los
productos envasados en plástico deben trasvasarse al cabo de cinco años, porque el
frasco puede presentar alteración, aunque lo más aconsejable es mantener un buen
control de inventarios con el fin de no guardar los productos químicos por mucho
tiempo. Para transportar los frascos de un lugar a otro no se deben tomar del cuello,
sino que éstos deben colocarse en una caja o recipiente de seguridad.
3. SITIO DE ALMACENAMIENTO Teniendo en cuenta el volumen de productos inflamables que se almacenen, en un laboratorio puede ser ideal instalar gabinetes de seguridad ya que ellos brindan todas
las medidas de protección contra el fuego tanto internas como externas, contra
posibles derrames, etc.
4. ALMACENAMIENTO EN ESTANTERÍASEl material más recomendado para las estanterías es el metal o el plástico,
dependiendo de la clase de productos a almacenar. Así por ejemplo, para almacenar
sustancias corrosivas se puede sobre plástico o sobre metal con recubrimiento plástico
especial como el teflón; el estante debe levantarse lo más cerca posible del suelo,
pero nunca directamente sobre él. Actualmente se consiguen estanterías con
bandejas colectoras corredizas. El estante debe mantenerse asegurado a la pared
para evitar que se mueva y preferiblemente las bandejas deben ser contenedoras. El
estante debe llenarse de tal manera que los recipientes que contienen líquidos y son
de mayor capacidad vayan abajo, los frascos altos hacia atrás y los pequeños
adelante; los productos más peligrosos abajo y los más inofensivos arriba. El producto
almacenado debe ser únicamente el necesario, no se recomienda tener grandes
existencias de un producto.
5. ORGANIZACIÓN DE LOS PRODUCTOS El proceso de clasificación por peligrosidad de los productos químicos puede hacerse
siguiendo la técnica del sistema de Naciones Unidas, la cual consiste en asignar a
cada producto químico una clasificación que determina su peligrosidad.
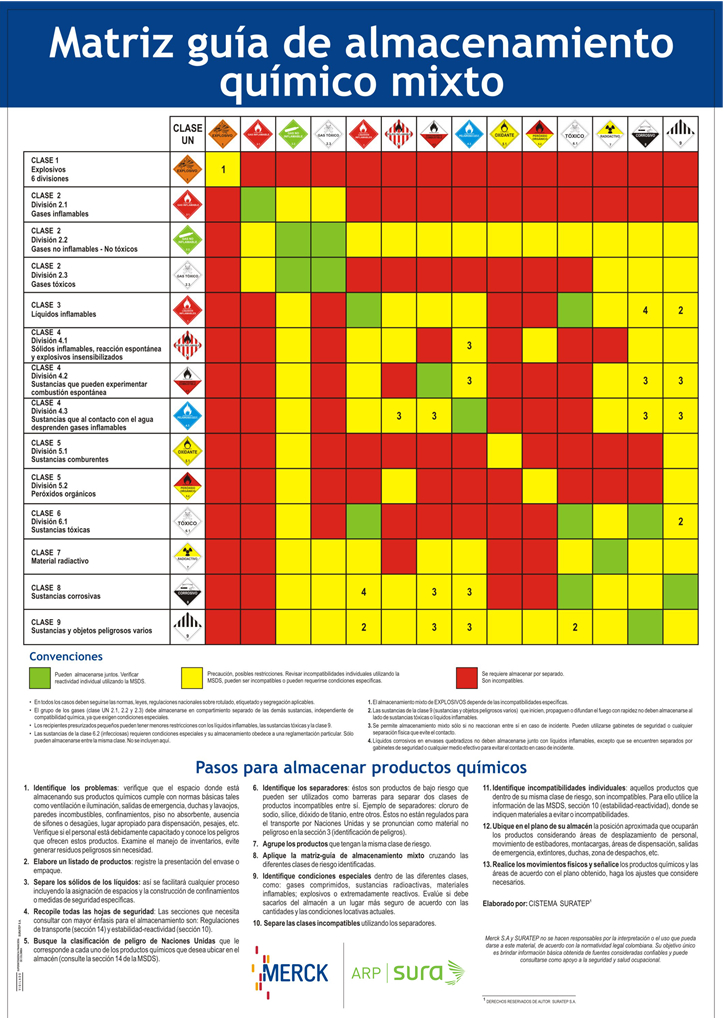
Convenciones:
Pueden almacenarse juntos. Verificar reactividad individual utilizando la MSDS. Precaución, posibles restricciones. Revisar incompatibilidades individuales, pueden ser
incompatibles o pueden requerirse condiciones específicas.
Se requiere almacenar por separado. Son incompatibles.
En todos los casos deben seguirse las normas, leyes, regulaciones nacionales sobre rotulado, etiquetado y segregación aplicables.
* El grupo de los gases (Clase UN 2.1, 2.2 y 2.3) deben almacenarse en compartimiento separado de las demás sustancias independiente de compatibilidad química ya que exigen
condiciones especiales.
Los recipientes presurizados pequeños pueden tener menores restricciones con los líquidos inflamables, las sustancias tóxicas y la clase 9.
Las sustancias de la clase 6.2 (Infecciosas) requieren condiciones especiales y su almacenamiento obedece a una reglamentación particular. Sólo pueden almacenarse entre
la misma clase.
1. El almacenamiento mixto de EXPLOSIVOS depende de las incompatibilidades específicas
2. Las sustancias de la clase 9 que inicien, propaguen o difundan el fuego con rapidez no
deben almacenarse al lado de sustancias tóxicas o líquidos inflamables.
3. Se permite almacenamiento Mixto sólo si no reaccionan entre sí en caso de incidente.
Pueden utilizarse gabinetes de seguridad o cualquier separación física que evite el contacto.
4. Líquidos corrosivos en envases quebradizos no deben almacenarse junto con líquidos
inflamables, excepto que se encuentren separados por gabinetes de seguridad o cualquier
medio efectivo para evitar el contacto en caso de incidente.



















